Mavyret (glecapravir, pibrentasvir) est une combinaison médicamenteuse à dose fixe utilisée dans le traitement de l’hépatite C chronique (VHC). Les médicaments utilisés dans Mavyret agissent en bloquant deux protéines individuelles que le virus doit répliquer.
Mavyret a été approuvé le 3 août 2017 par la Food and Drug Administration des États-Unis pour une utilisation chez les adultes de 18 ans et plus. La recherche suggère que le médicament peut atteindre des taux de guérison de 92% à 100% selon le sous-type de VHC, un chiffre qui correspond plus ou moins aux autres antiviraux à action directe actuellement utilisés dans le traitement de l’hépatite C.
Avantages et inconvénients
Mavyret est capable de traiter les six souches de VHC (génotypes) et peut être utilisé chez les personnes qui n’ont jamais été exposées au VHC et chez celles qui ont déjà échoué. De plus, le médicament peut être utilisé chez les personnes présentant une cirrhose compensée (dans laquelle le foie est toujours fonctionnel).
Mavyret a un avantage clé sur les médicaments similaires en ce sens qu’il peut traiter l’hépatite C chronique en aussi peu que huit semaines. Tous les autres médicaments ne nécessitent pas moins de 12 semaines pour les patients nouvellement traités. Cela comprend la combinaison de médicaments contre le VHC Epclusa qui est également approuvé pour les six génotypes.
Cependant, contrairement à Epclusa, Mavyret ne peut pas être utilisé chez les personnes présentant une cirrhose décompensée (dont le foie ne fonctionne plus).
Un autre facteur clé de différenciation est le prix. Alors que les médicaments comme Epclusa coûtent en gros 75 000 $ pour un cours de 12 semaines (890 $ par pilule), Mavyret est offert à 26 400 $ pour un cours de huit semaines (ou 439 $ par comprimé).
La différence de prix peut suffire à convaincre les assureurs de santé d’étendre le traitement aux 3,9 millions d’Américains chroniquement infectés par le VHC, dont la plupart doivent attendre jusqu’à ce qu’il y ait une insuffisance hépatique significative avant que le traitement puisse être approuvé.
Recommandations de prescription
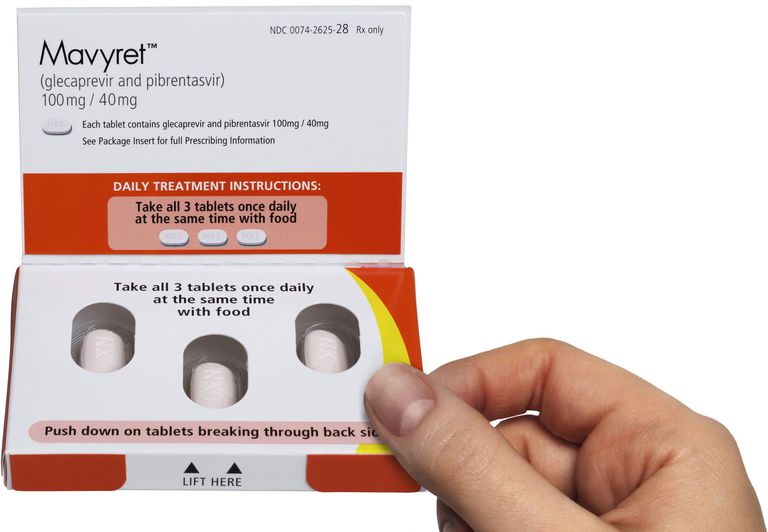
La posologie recommandée de Mavyret est de trois comprimés pris une fois par jour avec de la nourriture.
Chaque comprimé contient 100 milligrammes de glaçaprévir et 40 milligrammes de pibrentasvir. Les comprimés sont roses, oblongs, pelliculés et gravés «NXT» d’un côté.
La durée du traitement varie selon le génotype du VHC, l’expérience du traitement et l’état hépatique du patient, comme suit:
- Non traité sans cirrhose: huit semaines
- Antécédent de cirrhose compensée: 12 semaines
- Antécédemment traité avec le génotype 1 du VHC, 2, 4, 5 et 6 sans cirrhose: 8 à 16 semaines selon le traitement précédent
- Antécédents de traitement des génotypes 1, 2, 4, 5 et 6 du VHC avec cirrhose compensée: 12 à 16 semaines selon la thérapie précédente
- Auparavant traité avec le génotype 3 du VHC avec ou sans cirrhose: 16 semaines
Environ 75% des Américains atteints d’hépatite C ont le génotype 1, qui est le plus répandu mais aussi le plus difficile à traiter. By Effets secondaires
Les AAD de nouvelle génération comme Mavyret ont beaucoup moins d’effets secondaires que les thérapies de la génération précédente, dont beaucoup sont des génotypes 2 et 3, alors que seulement une petite poignée a des génotypes 4, 5 ou 6.
inclus l’interféron pégylé (peginterféron) et la ribavirine. Les effets secondaires les plus fréquemment associés à Mavyret (survenant chez plus de cinq pour cent des patients) comprennent:
- Maux de tête
- Fatigue
- Nausées
- Diarrhée
En général, les effets secondaires sont gérables et ont tendance à s’améliorer avec le temps. En fait, les recherches préalables à la mise sur le marché ont conclu que moins de un pour cent des personnes traitées par Mavyret interrompaient le traitement en raison d’effets secondaires intolérables.
Interactions médicamenteuses
L’utilisation de médicaments à base de rifampine, couramment utilisés pour traiter la tuberculose, est contre-indiquée pour Mavyret et doit être interrompue avant le début du traitement. Ceux-ci incluent des médicaments avec les noms de marque Mycobutin, Rifater, Rifamate, Rimactane, Rifadin, et Priftin.
D’autres médicaments sont connus pour interagir avec Mavyret et peuvent augmenter ou diminuer la concentration de Mavyret dans le sang.
Ce qui suit n’est pas recommandé pour Mavyret:
- La carbamépazine, utilisée pour traiter les convulsions et les troubles bipolaires
- Les contraceptifs oraux contenant de l’éthinylestradiol (œstrogène)
- Sustiva (éfavirenz) utilisé dans le traitement du VIH
- Atorvastatine, lovastatine et simvastatine hypercholestérolémie
- St. John’s Wort
Insuffisance hépatique
Mavyret est contre-indiqué chez les personnes ayant une insuffisance hépatique sévère (score Child-Pugh C) et n’est pas recommandé chez les personnes présentant une atteinte modérée (Child-Pugh B) .
Des tests de la fonction hépatique sont recommandés avant le début du traitement pour éviter les complications. Le score de Child-Pugh est également utile pour déterminer la gravité de la maladie du foie basée sur des tests sanguins et un examen des symptômes caractéristiques. R Réactivation de l’hépatite B
Mavyret doit être utilisé avec précaution chez les personnes qui ont à la fois l’hépatite B et l’hépatite C. Le virus de l’hépatite B (VHB) est connu pour être réactif pendant ou peu après le traitement. La réactivation peut être accompagnée de symptômes d’ictère et d’inflammation du foie. Si le traitement n’est pas arrêté immédiatement, la réactivation pourrait entraîner une insuffisance hépatique et même la mort.
Bien que l’infection par le VHB ne contre-indique pas l’utilisation de Mavyret, elle nécessiterait une surveillance plus étroite des enzymes hépatiques afin d’identifier les premiers signes de réactivation.
Pendant la grossesse
Bien que Mavyret ne soit pas contre-indiqué pendant la grossesse, il existe peu de données cliniques humaines disponibles pour évaluer le risque réel. Cela étant dit, des études chez l’animal ont montré que l’utilisation du glaçavrevir et du pibrentasvir pendant la grossesse n’est pas associée à des anomalies fœtales, y compris l’exposition pendant l’allaitement.
La consultation d’un spécialiste est recommandée non seulement pour évaluer les avantages et les risques du traitement, mais aussi pour déterminer si le traitement est urgent ou s’il peut être retardé après l’accouchement.
Pour prévenir la grossesse pendant le traitement, il est conseillé aux couples d’utiliser au moins deux méthodes de contraception non hormonales pendant et jusqu’à six mois après la fin du traitement. Étant donné que le contrôle des naissances à base d’œstrogènes n’est pas recommandé, consultez votre médecin pour voir si un contraceptif oral à base de progestatif seul peut être une option appropriée.